Importanta chimiei in viata noastra
Chimia este importanta in viata noastra deoarece ne ajuta sa intelegem si sa explicam multe procese si fenomene care au loc in lumea din jurul nostru, precum si in propriul nostru corp. Ea ne ajuta sa dezvoltam tehnologii noi, sa producem medicamente si alte produse utile, sa protejam mediul inconjurator si sa intelegem impactul pe care il avem asupra lui. De asemenea, chimia este esentiala in studiul si intelegerea materialelor, inclusiv a celor folosite in constructii si in dezvoltarea noilor tehnologii.
Reacția de substituție
Reacția de substituție este reacția în care un element chimic înlocuiește un alt element chimic din substanța compusă.
Schema reacției de substituție este:
A+BC=AC+B
- Ca reactanți avem o substanță simplă (A) și o substanță compusă (BC).
- Ca produși avem o substanță simplă (B) și o substanță compusă (AC).
- Substanța simplă ia locul primului element din substanță compusă și de aceea se mai numește și reacție de simplă înlocuire.
Ca tipuri de reacții de substituție avem reacția dintre un metal și o substanță compusă:
- cu apă
- cu un oxid
- cu un acid
- cu o sare
Reacția de substituție este importantă, întrucât se obțin substanțe chimice cu multe utilizări:
- în metalurgie la obținerea metalelor (Cu, Zn, Pb, Fe etc.) din oxizii lor naturali;
- în laborator la obținerea hidrogenului – H2;
- în laborator la obținerea unor metale – Fe, Zn,Hg etc.
Seria activității chimice ale metalelor
Seria activității chimice ale metalelor (Beketov-Volta) constituie o clasificare a metalelor după caracterul lor electrochimic, astfel metalele sunt așezate în ordinea descrescătoare a reactivității lor
Cu cât metalul este așezat mai la începutul seriei de activitate, cu atât el cedează mai ușor electronii de valență, trecând la ionul corespunzător și, deci, este mai reactiv din punct de vedere chimic.
| K Ca Na Mg | Al Mn Zn Cr Fe Ni Sn Pb | H2 | Cu Bi Sb Hg Ag | Pt Au | Reacționează cu oxigenul, formând oxizi | Nu | |
|---|---|---|---|---|---|---|---|
| Cu apa formează baze | Cu apa formează oxizi | Nu reacționează cu apa | |||||
| înlocuiesc hidrogenul din acizi | Nu înlocuiesc H2 din acizi | ||||||
| Orice metal poate înlocui din compuși, metalele situate după el in această serie | |||||||
- În reacția cu apa, sodiul reacționează energic (chiar violent) și la rece, pe când magneziul trebuie încălzit pentru a reacționa cu apa.
- Aluminiul poate scoate orice metal aflat după el în serie (Zn, Fe, Pb,Cu,Hg, Ag) din compușii acestora, dar nu poate scoate potasiul (K), calciul (Ca), sodiul (Na), magneziul (Mg) din compușii lor.
Reacția metalelor cu apa:
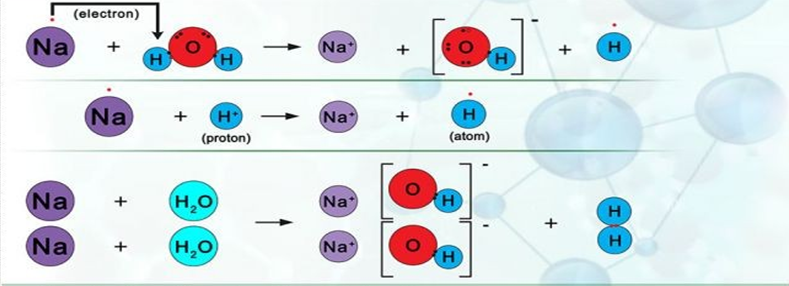
A) Reacția sodiului cu apa
Sodiul sau natrum (Na) este un metal alcalin cu o ractivitate chimică foarte mare, motiv pentru care în natură se întalnește doar sub formă de combinații. Reacționează energic cu apa, deoarece ionii se solvatează ușor; căldura degajată topește metalul, care plutește sub formă de sfere mici pe suprafața apei. Micile sfere de sodiu, dacă sunt localizate, se aprind și ard cu flacară galbenă.
2 moli + 2 moli --> 2 moli + 1 moli
2 Na + 2H2O --> 2NaOH+H2

Descrierea experimentului:
Pune în cristalizor puțină apă și adaugă câteva picături de fenolftaleină.
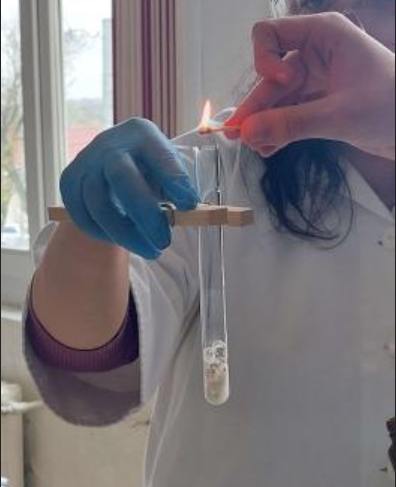
Cu multă grijă taie o bucățică mică de sodiu sub petrol (metalele alcaline, fiind foarte reactive, se păstrează sub petrol). Cu un clește pune bucățica de sodiu în apa din cristalizor și acoperă cu pâlnia. Vino cu un băț de chibrit aprins deasupra pâlniei. Ce observi ?
(Sodiul reacționează energic cu apa, înroșind fenolftaleina și când apropiem flacăra chibritului de pâlnie, are loc o pocnitură explozivă.)
Sodiul reacționează la rece și extrem de violent cu apa, cu formare de hidroxid de sodiu – NaOH (a înroșit fenolftaleina) și hidrogen – H2 (arde cu explozie în aer). Este o reacție de substituție, deoarece avem ca reactanți o substanță simplă și una compusă, iar ca produși avem tot o substanță simplă și una compusă:
2Na + 2H2O = 2NaOH + H2 ↑
B) Reacția magneziului cu apa:
Magneziul reacționează la cald cu apa, cu formare de hidroxid de magneziu – Mg(OH)2 (a înroșit fenolftaleina) și hidrogen – H2 (arde cu flacără în aer). Este o reacție de substituție, deoarece avem ca reactanți o substanță simplă și una compusă, iar ca produși avem tot o substanță simplă și una compusă:
Mg + 2H2O = Mg(OH)2 + H2 ↑
Reacția metalului cu un acid:
La combinarea magneziului cu acid clorhidric, putem observa bila de magneziu care se topește in acid, aceasta plutind rapid pe soluția de acid clorhidric, care la rândul ei degajă hidrogen. La aprinderea unui chibrit lângă hidrogen putem vedea o mică explozie, la fel ca în cazul reacției magneziului cu apa când s-a aprins chibritul.Mg + 2 HCl → MgCl2 + H2
Reactanți:Mg:
Denumiri: Magneziu
Aspect: pulbere gri, solid metalic alb-argintiu sub diferite forme
HCl:
Alte denumiri: Acid clorhidric ; Acid uriatic ; Clorura de hidroniu ; Acid clorhidric
Aspect: Lichid incolor, transparent, fum în aer dacă este concentrat Gaz ; gaz incolor ;
Produse:
MgCl2:
Denumiri: Clorura de magneziu; Diclorura de magneziu ; Aspect: Solid cristalin alb sau incolor; Solid delicios alb sub diferite forme
H2:
Denumiri: Hidrogen (H2) ; Moleculă de hidrogen
Aspect: Gaz comprimat incolor inodor
Rezultatul acestei reacții este clorura de magneziu și hidrogen, care se degajă
Clorura de magneziu este importantă pentru nutriția plantelor.
Reacția metalelor cu o sare:
A) Reacția cuprului cu azotatul de argint
Reacția cuprului cu azotatul de argint - AgNO3 decurge cu formare de azotat de cupru II – Cu(NO3)2 și argint – Ag. În seria activității chimice, cuprul este înaintea argintului și poate scoate argintul din compușii săi. Argintul nu reacționează cu sulfatul de cupru, fiindcă argintul este după cupru și nu îl poate scoate din compușii săi.
Este o reacție de substituție, deoarece avem ca reactanți o substanță simplă și una compusă, iar ca produși avem tot o substanță simplă și una compusă:
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag ↓
B) Reacția zincului cu azotatul de plumb
Reacția zincului cu azotatul de plumb - Pb(NO3)2, decurge cu formare de azotat de zinc – Zn(NO3)2 și plumb – Pb. Este o reacție de substituție, deoarece avem ca reactanți o substanță simplă și una compusă, iar ca produși avem tot o substanță simplă și una compusă:
Zn+Pb(NO3)2=Zn(NO3)2 + Pb↓
Reacția nemetalelor cu un oxid metalic
A) Reacția dintre carbon și oxid cupric
Oxidul de cupru II – CuO, reacționează la cald cu carbonul, cu formare de cupru metalic (roșiatic) și dioxid de carbon – CO2 (stinge flacăra). Această reacție servește la obținerea metalelor din oxizii lor naturali, în metalurgie. Este o reacție de substituție, deoarece avem ca reactanți o substanță simplă și una compusă, iar ca produși avem tot o substanță simplă și una compusă:
2CuO+C=2Cu↓+CO2
Reacțiile de substitutie in viața de zi cu zi
Reacțiile de substituție sunt procese chimice importante care implică înlocuirea unui atom sau grup de atomi cu un alt atom sau grup de atomi. Aceste reacții sunt utilizate în diverse domenii și aplicații, cum ar fi conservarea alimentelor, producția de medicamente și produse chimice.
1) Reacția sodiului cu apa:
Reacția dintre sodiu și apă este o reacție exoterma și produce hidroxid de sodiu și hidrogen gazoasă. Această reacție este folosită în producția de hidroxid de sodiu, care este utilizat în industria alimentară, farmaceutică și cosmetică. De asemenea, reacția este folosită și în producția de baterii și în sinteza de diverse compuși chimici.
2) Reacția magneziului cu apa:
Reacția dintre magneziu și apă poate fi folosită în diverse situații din viața de zi cu zi, de exemplu în producerea hidrogenului și în diverse experimente școlare. De asemenea, magneziul poate fi folosit ca agent de reducere în diverse aplicații industriale, cum ar fi producția de titan sau de aluminiu. Totodată, magneziul este un element important în compoziția unor aliaje metalice, cum ar fi magneziul-aluminiu și magneziul-zinc.
3) Reacția magneziului cu acid clorhidric
Reacția dintre magneziu și acidul clorhidric este o reacție chimică care se poate observa în laboratorul de chimie, dar nu are o utilizare practică semnificativă în viața de zi cu zi. Cu toate acestea, magneziul și acidul clorhidric sunt utilizați în diverse domenii, cum ar fi industria auto, construcțiile și producția de alimente, printre altele.
4) Reacția zincului cu azotatul de plumb:
Reacția dintre zinc și azotatul de plumb nu are o utilizare semnificativă în viața de zi cu zi, ci este folosită în cercetarea științifică pentru sinteza și studiul proprietăților compușilor organici și anorganici.
5) Reacția dintre carbon și oxid cupric:
Reacția dintre carbon și oxidul cupric este utilizată pentru a produce cupru metalic prin reducere. Cuprul este un material larg utilizat în producția de conducte, cabluri electrice, piese de mașini, componente electronice și obiecte decorative, și această metodă de producție joacă un rol important în industrie.
Galerie

Reactia sodiului cu apa
View more
Reactia sodiului cu apa
DETALII
View more
Reactia sodiului cu apa
DETALII
View more
Reactia
dintre sulfat de cupru și hidroxid de natriu
DETALII
View more
Reactia
dintre clorura de fier III și hidroxidul de sodiu
DETALII
View more
Reactia
dintre clorura de sodiu și azotatul de argint
DETALII
View more.jpg)
Reactia
dintre clorură de nichel și hidroxid de natriu
DETALII
View more.jpg)
Reactia
dintre clorură de nichel și hidroxid de natriu
DETALII
">View more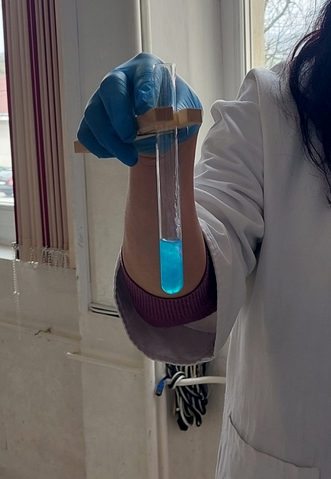
.jpg)
.jpg)